
科目: 来源: 题型:选择题
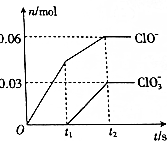 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完成反应(已知反应过程放热),ClO-和ClO3-的物质的量(n)与反应时间(t)的变换关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完成反应(已知反应过程放热),ClO-和ClO3-的物质的量(n)与反应时间(t)的变换关系如图所示.下列说法不正确的是( )| A. | Cl2和苛性钾溶液在不同温度下可能发生不同反应 | |
| B. | t1时刻,c(Cl-):c(ClO-)=5:1 | |
| C. | 原苛性钾溶液中KOH的物质的量为0.3mol | |
| D. | t2时刻,n(还原产物):n(氧化产物)=7:3 |
查看答案和解析>>
科目: 来源: 题型:解答题
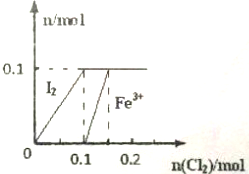 某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.80g | B. | 3.36g | C. | 4.48g | D. | 5.60g |
查看答案和解析>>
科目: 来源: 题型:选择题
 某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )| A. | 溶液中的阳离子有H+、Mg2+、Al3+、NH${\;}_{4}^{+}$ | |
| B. | 溶液中n(NH${\;}_{4}^{+}$)=0.2 mol | |
| C. | 溶液中一定不含CO${\;}_{3}^{2-}$和NO${\;}_{3}^{-}$,可能含有SO${\;}_{4}^{2-}$ | |
| D. | n(H+):n(Al3+):n(Mg2+)=2:2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol H2与0.5 mol H2和O2的混合物所含的原子数目相同 | |
| B. | 16 g O2含有6.02×1023个氧分子 | |
| C. | 1 mol H2O中含有2 mol H2,1molO,总共所含电子的物质的量为10 mol | |
| D. | 物质的量为1 mol的任何微粒的质量与NA个该种微粒的质量在任何情况下都相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
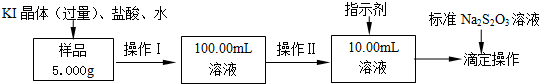
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应开始时的速率:甲>乙 | |
| B. | 反应结束时,pH值:甲=乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲=乙 | |
| D. | 反应所需时间:甲>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com