
科目: 来源: 题型:解答题
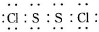 ,它不稳定,在水中易发生岐
,它不稳定,在水中易发生岐| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则该反应的△H<0 | |
| B. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 | |
| C. | 锌与稀硫酸反应时加少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度 | |
| D. | 甲基苯环上的一个氢原子被含3个碳原子的烷基取代的产物可能有3种 |
查看答案和解析>>
科目: 来源: 题型:解答题
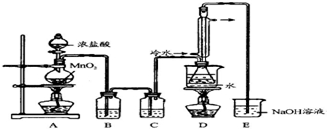
 某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ①NaCl ②NaOH ③NH3•H2O ④H2SO4 | B. | ①H2SO4 ②NaOH ③NH3•H2O ④NaCl | ||
| C. | ①NaCl ②NH3•H2O ③NaOH ④H2SO4 | D. | ①H2SO4 ②NH3•H2O ③NaOH ④NaCl |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 CO2转化率 $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com