
科目: 来源: 题型:选择题
| A. | 燃烧反应一定是放热反应 | |
| B. | 反应物总能量大于生成物总能量 | |
| C. | 反应物键能总和大于生成物键能总和 | |
| D. | 是体系将储存的能量释放出来的过程 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 条 件 | 离子组 | 离子共存判断及离子方程式 |
| A | 常温下,由水电离出的C(H+)为1×10-12 mol•L-1 | K+、Cl-、S2-SO32- | 一定能大量共存 |
| B | 滴加氨水 | Na+、Fe3+、Cl- | 不能大量共存 Fe3++3OH-═Fe(OH)3↓ |
| C | p=1的溶液 | Fe3+、I- Cl- | 不能大量共存 2Fe3++2I-═2Fe2++I2 |
| D | 通入少量SO2气体 | K+、Na+、ClO- | 不能大量共存 2ClO-+SO2+H2O═2HClO+SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
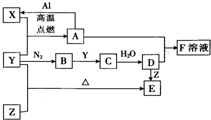 已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题:
已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
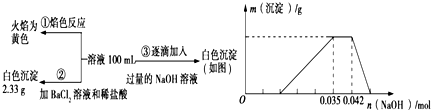
查看答案和解析>>
科目: 来源: 题型:选择题
 氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )| A. | 产生氯气的离子方程式:16H++10Cl-+2MnO${\;}_{4}^{-}$=2Mn2++5Cl2↑+8H2O | |
| B. | ⑦处变血红色,是因为2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3 | |
| C. | ②褪色,③处先变红后褪色,⑤处出现淡黄色固体 | |
| D. | ④处变蓝,⑥处变橙红,能说明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ⑥ | C. | ①②③④⑤⑦⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸型酸雨的形成会涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | 工业上制取粗硅的化学方程式SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl?+ClO?+2H+=Cl2↑+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化 | |
| B. | 两个都是氧化还原反应 | |
| C. | 盐酸都是被还原 | |
| D. | 等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com