
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
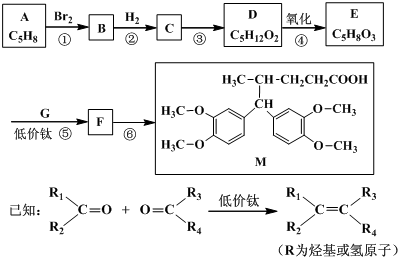
 (其中之一);.
(其中之一);. 或
或 或
或 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.完成下列填空:
碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.完成下列填空:查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 | CN- 浓度 | 加入救援废水中的K2FeO4 | ||
| 救援废水 | 残余 | 浓度 | 利用率 | |
| ① | 10mg/L | 0.082mg/L | 75mg/L | 67.14% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
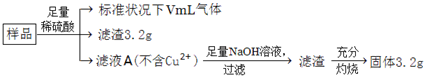
| A. | 滤液A中阳离子不可能含H+、Fe2+、Fe3+ | |
| B. | 样品中金属Fe的质量为2.24g | |
| C. | 样品中CuO的质量为4.0g | |
| D. | V=224 |
查看答案和解析>>
科目: 来源: 题型:选择题
 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.1 mol/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3S2-+2NO3-+8H+→2NO↑+3S↓+4H2O | |
| B. | S2-+2NO3-+4H+→2NO2↑+S↓+2H2O | |
| C. | Fe3++3NO3-+5H2S+2H+→3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++5NO3-+8H2S+4H+→5NO↑+8S↓+Fe2++10H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生成56.0LN2(标准状况) | |
| B. | 有0.300molKNO3被氧化 | |
| C. | 被氧化的N原子的物质的量为4.75mol | |
| D. | 转移电子的物质的量为1.50mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com