
科目: 来源: 题型:解答题
 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -116 |
查看答案和解析>>
科目: 来源: 题型:解答题
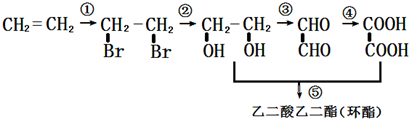
 ;
; +H2O,;
+H2O,; .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若A为单一气体,则不是甲烷就是乙烯 | |
| B. | 若A为单一气体,则可能是丙烷 | |
| C. | 若A为混合气体,则可能是甲烷,丙烯,乙炔按体积比2:1:1混合而成 | |
| D. | 若A为混合气体,则可能是乙烯,乙烷按质量比14:22混合而成室温时 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C2H4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | Cu2+ | H+ | Cl- | SO$\stackrel{2-}{4}$ |
| c/(mol•L-1) | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 40% | B. | 50% | C. | 70% | D. | 90% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 101kPa时,H2(g)+1/2O2(g)═H2O(g)△H=-248kJ•mol-1,H2的燃烧热为248kJ•mol-1 | |
| B. | 利用盖斯定律可以计算难以测量的反应热 | |
| C. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的氢氧化钠的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 相同条件下,如果1 mol H原子所具有的能量为E1,1 mol H2所具有能量为E2,则2E1=E2 |
查看答案和解析>>
科目: 来源: 题型:选择题
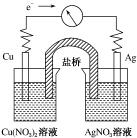 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | Cu作负极,发生还原反应 | |
| C. | 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 | |
| D. | 工作一段时间后,AgNO3溶液中c(Ag+)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com