
科目: 来源: 题型:解答题

| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| B. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| C. | 石英用于生产光导纤维和计算机芯片 | |
| D. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
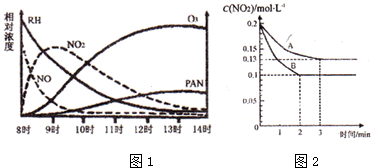
查看答案和解析>>
科目: 来源: 题型:解答题
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.查看答案和解析>>
科目: 来源: 题型:解答题
 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3:2:1 | B. | 6:3:2 | C. | 9:3:1 | D. | 12:6:5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1gH2和8g O2 | |
| B. | 1molCO和22.4L水蒸气(一个标准大气压、100℃) | |
| C. | 18g水和标况时22.4L CO2 | |
| D. | 3molSO2和2mol SO3 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com