
科目: 来源: 题型:选择题
| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,44g CO2中含有的分子数为NA | |
| C. | 在常温常压下,22.4L Cl2含有的分子数为1.0NA | |
| D. | 在标准状况下,22.4L H2O含有的分子数为1.0NA |
查看答案和解析>>
科目: 来源: 题型:解答题
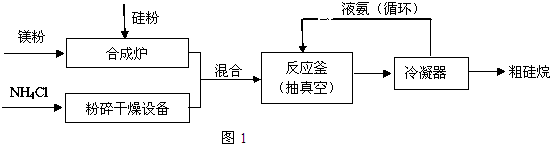
 .
. (2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④⑤ | B. | ②⑤⑥ | C. | ②③④⑥ | D. | ①④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的铁粉加入稀硝酸中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe2+ |
| B | AlCl3溶液中滴加过量的氨水 | 先出现白色沉淀,后沉淀又逐渐溶解 | 氢氧化铝能溶于氨水 |
| C | 铝箔插入稀硝酸中 | 无明显现象 | 铝箔表面被稀硝酸氧化形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓硫酸点到pH试纸上 | 试纸变黑色 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 1,2,3,4-四氢化萘的结构简式是
1,2,3,4-四氢化萘的结构简式是 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g•cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com