
科目: 来源: 题型:解答题
 (Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算:
(Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| B. | pH=1的溶液:Na+、K+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | |
| C. | 含有大量Al3+的溶液:Na+、NH4+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 含有大量NO3-的溶液:H+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
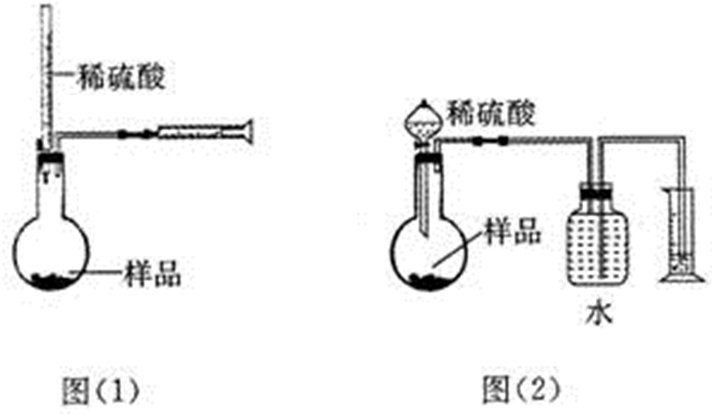
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N溶液无颜色 | |
| B. | M溶液里的两种阳离子为Na+和NH4+ | |
| C. | N溶液滴入BaCl2溶液无明显现象 | |
| D. | M溶液中通入足量CO2有白色沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ | |
| B. | 充分反应后,共消耗铁56g | |
| C. | 在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 | |
| D. | 当加入16.8 g铁粉时,可生成标准状况下6.72 L气体’ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com