
科目: 来源: 题型:解答题
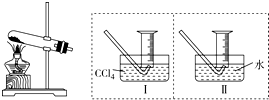 某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.
某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室用浓硫酸和乙醇制乙烯时,应把温度计的水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 用浓硫酸配置一定物质的量浓度的稀硫酸时,应在量取浓硫酸后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中 | |
| C. | 液态溴应贮存在磨口的细口瓶中,加水液封,加盖橡胶塞,并放置于阴凉处 | |
| D. | 应用渗析法提纯胶体时,要不断更换烧杯中的水(或用流动的水)以提高渗析效果 |
查看答案和解析>>
科目: 来源: 题型:解答题
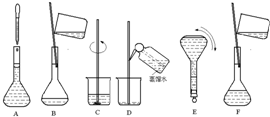 如图表示配制 100mL 0.100ol•L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
如图表示配制 100mL 0.100ol•L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol NH4+所含有的电子数为11 NA | |
| B. | 20g氖气所含有的分子数约为 3.01×1023 | |
| C. | 标准状况下,22.4LSO2气体所含的原子数为 NA | |
| D. | 常温常压下,32gO2和O3的混合气体所含原子数为2 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 物理量 实验序号 | V(溶液)/mL | NH4Cl/g | 温度/℃ | pH | … |
| 1 | 100 | m | T1 | … | |
| 2 | 100 | m | T2 | … | |
| 3 | 100 | 2m | T2 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com