
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| A | B | C | ||
| (1) | 1 | 3 | 0 | 放出热量a kJ |
| (2) | 0 | 0 | 2 | 吸收热量b kJ |
| (3) | 2 | 6 | 0 | 放出热量c kJ |
| A. | A的体积分数:(2)>(1)>(3) | |
| B. | 三个容器内反应的平衡常数:K(3)=K2(1)=K2(2) | |
| C. | 达平衡时体系压强:P(3)=2P(1) | |
| D. | 热量关系:a+b=50 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Na2O2+2CO2=2Na2CO3+O2 | |
| B. | Na2O2+MnO2=Na2MnO4 | |
| C. | 5Na2O2+2MnO4-+16H+=10Na++2Mn2++5O2↑+8H2O | |
| D. | 2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热、蒸发得到NaOH晶体 | |
| B. | 向Fe2(SO4)3溶液加入足量NaOH溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | |
| D. | 常温下将Al片放入浓硝酸中,无明显变化,所以Al与浓硝酸不反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
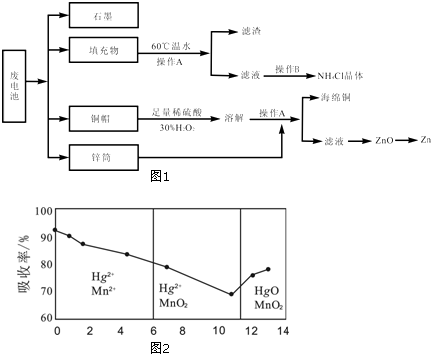
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com