
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
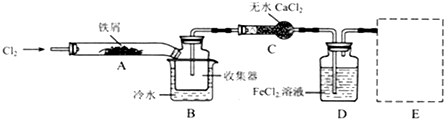
 、Cl2+2OH-=Cl-+ClO-+H2O.
、Cl2+2OH-=Cl-+ClO-+H2O.| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液. | 溶液中出现红色. | 说明:假设②不成立,假设①或③成立; 反应的离子方程式是Fe3++3SCN-=Fe(SCN)3. |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液. | 溶液紫红色退去 | 说明:假设②或③成立. |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com