
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3 | B. | CaCO3 | C. | KHCO3 | D. | Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+一定不存在 | |
| B. | 该溶液中含CO32-离子的浓度为0.1 mol/L | |
| C. | Cl-可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 澄清的石灰水与盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液 Cu+Ag+=Cu2++Ag | |
| D. | 大理石溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目: 来源: 题型:解答题
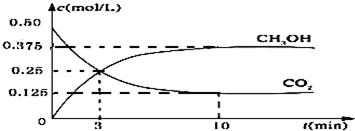
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L | |
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 | |
| C. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如图乙,则T2>T1 | |
| D. | 达平衡后,缩小容器容积,则反应速率变化图象可以用图丙表示 |
查看答案和解析>>
科目: 来源: 题型:解答题
 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:| 反应时间/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com