
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
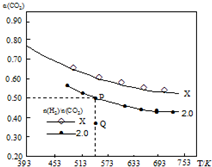 在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 氢碳比:X<2.0 | |
| C. | 在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) | |
| D. | P点温度下,反应的平衡常数为512 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1CH3COONa溶液与0.1 mol•L-1CH3COOH溶液等体积混合(pH=4.75):c (CH3COO-)+c (CH3COOH)=2 c(Na+) | |
| C. | 0.1mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.1mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合:c (HCO${\;}_{3}^{-}$)+2c (H+)+3c (H2CO3)=c(CO${\;}_{3}^{2-}$)+2c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制备干燥的NH3:加热浓氨水,将生成的气体通过盛有浓硫酸的洗气瓶 | |
| B. | 提纯含有少量HCl的CO2:将混合气体依次通过盛有饱和碳酸钠溶液、浓硫酸的洗气瓶 | |
| C. | 检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的烧瓶,先后置于冷水和热水中,观察烧瓶中气体颜色的变化 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 在海轮船壳上镶入锌块保护海轮,利用的是牺牲阳极的阴极保护法 | |
| B. | 加入合适的催化剂,能降低反应活化能,从而改变反应的焓变 | |
| C. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| D. | 稀醋酸中加入少量CH3COONa固体,醋酸的电离程度减小,c(CH3COO-)增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
 “人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
“人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,光能和电能全部转化为化学能 | |
| B. | 该装置工作时,H+向b极板移动 | |
| C. | 反应6CO2+8H2O$\frac{\underline{\;\;\;光\;\;\;}}{通电}$2C3H8O+9O2,每消耗1 mol CO2 转移4 mol电子 | |
| D. | 电极a上CO2参与的电极反应为:3CO2+18H++18e-═C3H8O+5H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | Ca(HCO3)2溶液中加足量NaOH溶液:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O | |
| C. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO${\;}_{3}^{-}$+H2O | |
| D. | 明矾常用于净水:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl(饱和溶液)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| B. | Al2O3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{电解}{→}$Al | |
| C. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com