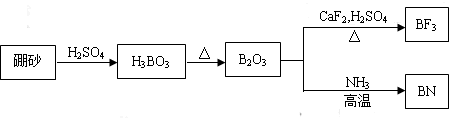
1.I.高铁酸钾(K
2FeO
4)是一种集强氧化性、吸附、絮凝于一体的新型多功能水处理剂,生产工艺如图1:
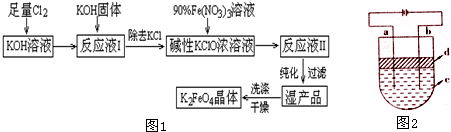
已知:
①温度较低时:2KOH+Cl
2→KCl+KClO+H
2O
②温度较高时:6KOH+3Cl
2→5KCl+KClO
3+3H
2O
③Fe(NO
3)
3+KClO+KOH→K
2FeO
4+KNO
3+KCl+H
2O(未配平)
(1)该生产应在温度较低的情况下进行(填“较高”或“较低”).
(2)请配平反应③并回答有关问题:
2Fe(NO
3)
3+3KClO+10KOH→2K
2FeO
4+6KNO
3+3KCl+5H
2O
当生成396克K
2FeO
4理论上需要67.2L Cl
2(标况下),整个过程中转移的电子数目为6mol.
(3)在“反应液I”中加KOH固体的目的是A、B.
A.为下一步反应提供反应物
B.与“反应液I”中过量的Cl
2继续反应,生成更多的KClO
C.KOH固体溶解时会放出较多的热量,有利于提高反应速率
D.使副产物KClO
3转化为 KClO
II.由于Fe(OH)
2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色、纯净的Fe(OH)
2沉淀.应用如图2的电解实验可制得纯净的Fe(OH)
2沉淀.两电极的材料分别为石墨和铁.
(1)a电极材料应为Fe,电极反应式为Fe-2e
-=Fe
2+.
(2)电解液c可以是BC.(填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl
2溶液
(3)d是苯(C
6H
6),其作用为隔绝空气防止氢氧化亚铁被氧化.
(4)为了在较短时间内看到白色沉淀,可采取的措施是B、C.(填编号)
A.改用稀硫酸做电解液 B.适当增大电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
(5)若c用Na
2SO
4溶液,当电解一段时间看到白色Fe(OH)
2沉淀后,再反接电源电解,除在电极上可以看到气泡外,混合物中另一明显现象为白色沉淀迅速变为灰绿色,最终变为红褐色.