
科目: 来源: 题型:解答题
 塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为:
塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为: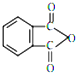 +2CH3CH2CH2CH2OH→
+2CH3CH2CH2CH2OH→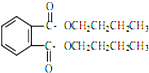 +H2O
+H2O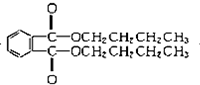 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$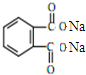 +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.查看答案和解析>>
科目: 来源: 题型:解答题
 ,反应类型:属于取代反应;
,反应类型:属于取代反应; ,反应类型:属于加成反应.
,反应类型:属于加成反应.
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
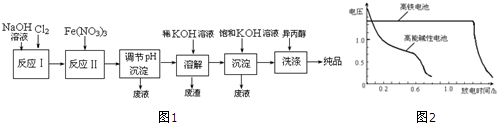
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溴乙烷$\stackrel{NaOH/水}{→}$乙醇$\stackrel{浓硫酸}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| B. | 溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| C. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{HBr}{→}$溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| D. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 |
查看答案和解析>>
科目: 来源: 题型:解答题
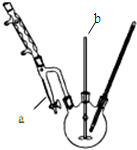
 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com