
科目: 来源: 题型:解答题
 在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:
在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 醋酸溶液 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 25.0 | 25.1 | 27.8 |
| 2 | 25.1 | 25.3 | 27.9 |
| 3 | 25.2 | 25.5 | 28.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1的硫酸溶液进行中和热的测定,实验装置如图所示:
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1的硫酸溶液进行中和热的测定,实验装置如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
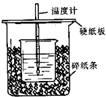 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
 .
.查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com