
科目: 来源: 题型:选择题
| A. | 加热使CuSO4•5H2O失水 | B. | 加热使KMnO4分解 | ||
| C. | 加热熔化烧碱 | D. | 加热分解碱式碳酸铜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2和澄清石灰水 | B. | NaOH溶液和CO2 | ||
| C. | Na2CO3溶液和盐酸 | D. | NaHCO3溶液和盐酸 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用钠制取钛:TiCl4+4Na=4NaCl+Ti该反应转移4e- | |
| B. | SO2+2H2S=3S↓+2H2O中,氧化产物与还原产物的物质的量之比为2:3 | |
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,二氧化硅是氧化剂,C是还原剂 | |
| D. | HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2中,每生成1molHg反应转移4mole- |
查看答案和解析>>
科目: 来源: 题型:解答题
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:查看答案和解析>>
科目: 来源: 题型:解答题

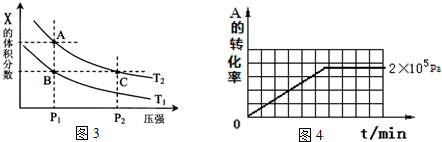
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
 ;
; ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com