
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图:
聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
 如图是实验室制取溴苯的装置图
如图是实验室制取溴苯的装置图查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
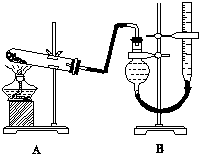 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目: 来源: 题型:填空题
 如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:
如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com