
科目: 来源: 题型:解答题
 SO2的催化氧化是工业上生产硫酸的关键步骤.
SO2的催化氧化是工业上生产硫酸的关键步骤.查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kj•mol-1 | a | b | c | d | e |
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
查看答案和解析>>
科目: 来源: 题型:解答题


 ;反应过程中只会释放出一种小分子CH4.
;反应过程中只会释放出一种小分子CH4.查看答案和解析>>
科目: 来源: 题型:解答题

 、
、 .
.查看答案和解析>>
科目: 来源: 题型:解答题

 ,电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d46s2.
,电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d46s2.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 0℃ | 50℃ | 80℃ | |
| Ca(OH)2 | 0.173g | 0.13g | 0.094g |
| Ba(OH)2•8H2O | 1.64g | 13.2g | 101.4g |
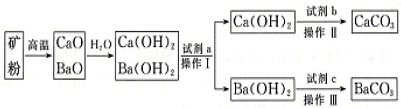
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同样是在氯气中点燃,铁少量生成的是氯化铁,过量时则生成氯化亚铁 | |
| B. | 同样是试纸检测,检验气体需要润湿,检验溶液时则一般不能润湿 | |
| C. | 同样是配制溶液,一定质量分数的溶液配制使用烧杯,而一定物质的量浓度的溶液配制则还需要容量瓶 | |
| D. | 同样是浓溶液(设其质量分数为ω )与水等体积混合,所得硫酸的浓度大于 0.5ω,氨水的则小于 0.5ω |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com