
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目: 来源: 题型:选择题
 甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )
甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )| A. | T1℃时,甲、乙饱和溶液的物质的量浓度一定相等 | |
| B. | T1℃和T2℃时,甲的饱和溶液的质量分数之比为9:13 | |
| C. | T1℃时,在100g水中加入60g乙,则c(乙)=$\frac{1000×ρ(乙)×37.5%}{M(乙)}$ | |
| D. | T1℃和T2℃时,甲的饱和溶液的物质的量浓度之比为9:13 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 呈碱性 | B. | 呈酸性 | C. | 呈中性 | D. | c(OH-)=10c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某离子第三层上和第二层上的电子数均为第一层的4倍 | |
| B. | Cl-的结构示意图: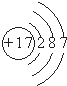 | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C和14N的质量数相等,互称为同位素 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | O2是还原产物,Mn2+是氧化产物 | |
| B. | Na2O2既是氧化剂,又是还原剂 | |
| C. | 标准状况下,产生22.4L O2时反应转移2mol e- | |
| D. | 通常用浓盐酸酸化高锰酸钾溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| D. | 电解NaCl溶液得到22.4L H2(标准状况),理论上需要转移NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com