
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶体粒子 | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 在标准状况下,22.4L H2和8 g 氦气均含有NA个分子 | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA个 |
查看答案和解析>>
科目: 来源: 题型:解答题
 有如下有机物:(每空一分)
有如下有机物:(每空一分) ②
② ③
③ ④CH3CH=CHCH3 ⑤
④CH3CH=CHCH3 ⑤ ⑥
⑥ ⑦
⑦
 ,其分子中碳原子sp3杂化.
,其分子中碳原子sp3杂化.查看答案和解析>>
科目: 来源: 题型:填空题
 无水硫酸亚铁是一种白色粉末,其水溶液为浅绿色.常见其七水化合物晶体,俗称绿矾(FeSO4•7H2O),主要用于净水、照相制版及在医药上作补血剂治疗缺铁性贫血等.某课外小组为了测定某补血剂中铁元素的含量,进行了如下实验:
无水硫酸亚铁是一种白色粉末,其水溶液为浅绿色.常见其七水化合物晶体,俗称绿矾(FeSO4•7H2O),主要用于净水、照相制版及在医药上作补血剂治疗缺铁性贫血等.某课外小组为了测定某补血剂中铁元素的含量,进行了如下实验:| 滴定次数 实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL (初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL (终读数) | 15.85 | 15.22 | 14.98 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{a}{22.4}$ mol | B. | $\frac{a}{11.2}$mol | C. | $\frac{3a}{22.4}$ mol | D. | $\frac{3a}{11.2}$mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 风力发电是化学能转换为电能 | |
| B. | 动物体内的葡萄糖被氧化成CO2,是热能转换成化学能 | |
| C. | 植物通过光合作用将CO2转化为葡萄糖,是将太阳能转换成热能 | |
| D. | 植物燃烧时放出的能量来源于太阳能 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
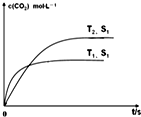 汽车尾气净化的主要原理为:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0
汽车尾气净化的主要原理为:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com