
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
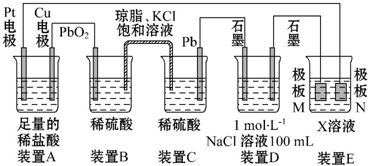
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 阳极发生的电极反应为Cu2++2e-═Cu | |
| B. | 阴极发生的电极反应为4OH--4e-═2H2O+O2↑ | |
| C. | 若有6.4g金属Cu析出,生成的O2一定为0.05mol | |
| D. | 电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2v正(HF)=v逆(H2O) | B. | v(H2O)=2v(SiF4) | ||
| C. | SiO2的质量保持不变 | D. | 反应物不再转化为生成物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同温度下,H2(g)+CO2(g)?CO(g)+H2O(g)中,密闭容器中两种反应物浓度为0.020 mol/L的反应速率大于两种反应物浓度为0.010 mol/L的反应速率 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应速率:两者相同 | |
| B. | 消耗HNO3的物质的量:前者多,后者少 | |
| C. | 反应生成气体的颜色:前者浅,后者深 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com