
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
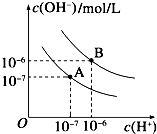 已知水在25℃和95℃时的电离平衡曲线如下图所示:
已知水在25℃和95℃时的电离平衡曲线如下图所示:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 转移电子的数目为0.2NA | B. | 所得溶液中溶质的质量分数为2.3% | ||
| C. | 产生气体的体积为1.12L | D. | 产生的气体含有0.1mol电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10.6g | B. | 12.6g | ||
| C. | 15.9g | D. | 数据不足,无法确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解法制铝时一般是用熔融的氧化铝进行电解,但也可用相应的盐,如熔融态的氧化铝 | |
| B. | 电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性 | |
| C. | 在氯碱工业中,电解池中的阳极产生的是Na0H和H2 | |
| D. | 氯碱工业和金属钠的生产中都用到了NaCl,在电解时它们的阴极都是Cl-失电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原铁和铝的物质的量相等 | |
| B. | 原盐酸的浓度为2mol•L-1 | |
| C. | 铁加入盐酸中的离子方程式为2Fe+6H+=2Fe3++3H2↑ | |
| D. | 盐酸与氢氧化钠溶液的物质的量浓度之比为1:3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol/L pH=3的H2A溶液与0.01mol pH=11的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A2-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com