
科目: 来源: 题型:选择题

| A. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| B. | Na2CO3的热稳定性大于NaHCO3 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目: 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
. 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目: 来源: 题型:解答题
| B | ||
| A | C |
查看答案和解析>>
科目: 来源: 题型:选择题
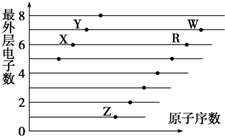
| A. | X和R在同一主族 | |
| B. | 含氧酸酸性:W>R | |
| C. | X与W可以形成酸性氧化物 | |
| D. | X、Z形成的化合物中可能含有共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
 短周期元素X.Y.Z.W在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是( )
短周期元素X.Y.Z.W在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是( )| A. | x与同主族且相邻元素的气态氢化物的沸点,前者高于后者 | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | x的气态氢化物与w的最高价氧化物的水化物反应只能生成一种盐 | |
| D. | x与H、O元素形成的化合物可以组成一种盐,其中X.H.O元素原子个数之比为2:4:3 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 元素形成的简单离子的半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的强 | |
| C. | X 的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2 周期、第ⅥA族 |
查看答案和解析>>
科目: 来源: 题型:解答题
 生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:
生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入铁粉和石棉绒的混合物,再结合一些步骤,就可以完成髙温下“Fe与水蒸气的反应实验”(己知石棉绒是耐高温材料,不与水和铁反应).
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入铁粉和石棉绒的混合物,再结合一些步骤,就可以完成髙温下“Fe与水蒸气的反应实验”(己知石棉绒是耐高温材料,不与水和铁反应).| 实验步骤 | 预期实验现象与结论 |
| 取反应后干燥的固体于试管中,加入足量的1mol•L-1硫酸溶解 | |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com