
科目: 来源: 题型:选择题
| A. | 3.3×1023 | B. | 3.3×1024 | C. | 7.5×1023 | D. | 7.5×1022 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4Cl+NaOH $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+H2O+NH3↑ | |
| B. | 2H2S+O2═2H2O+2S↓ | |
| C. | NaH+H2O═NaOH+H2↑ | |
| D. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下56 g 铁原子 | B. | 20℃、101 kPa时36.5g HCl | ||
| C. | 标准状况下6.02×1023 个NH3 | D. | 标准状况下1mol C2H5OH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol金属钠含有的电子数 | |
| B. | 1 L 1 mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4 L四氯化碳所含的分子数 | |
| D. | 0.012 kg 12C所含的原子数 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从活塞放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 两种互不相溶,密度也不相同的液体可以用分液漏斗分离,例如苯和水 |
查看答案和解析>>
科目: 来源: 题型:填空题
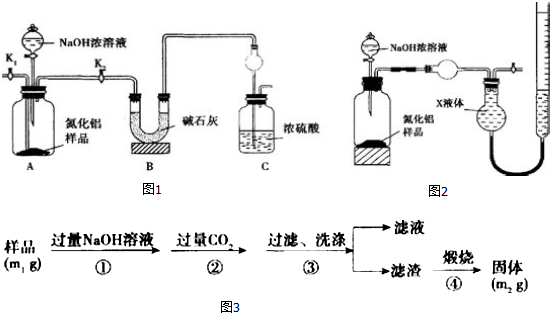
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com