
科目: 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
查看答案和解析>>
科目: 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
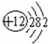 ,⑧
,⑧ ;
;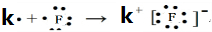 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4molA+2molB | |
| B. | 3molC+1molD+1molB | |
| C. | 3molC+0.8molD | |
| D. | 1.6molA+0.8molB+0.6molC+0.3molD |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液未呈血红色,说明稀硝酸不能将Fe氧化为Fe3+ | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉,充分反应后过滤 | |
| C. | 比较Fe(OH)3和Al(OH)3的Ksp:向0.1mol•L-1的FeCl3溶液中滴加0.1mol•L-1氨水至不再产生沉淀,然后再滴入0.1mol•L-1A1Cl3溶液,观察现象 | |
| D. | 验证氧化性Fe3+<Br2<Cl2;向试管中依次加入1mL0.1mol•L-1FeBr2溶液、几滴KSCN溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机层和水层中的现象. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.05mol | B. | 0.075mol | C. | 0.15mol | D. | 0.2mol |
查看答案和解析>>
科目: 来源: 题型:解答题
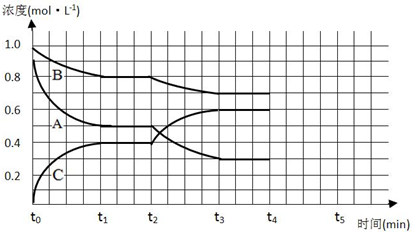
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溴化碘与Br2、I2具有相似的化学性质 | |
| B. | 在许多反应中,IBr是一种强氧化剂 | |
| C. | 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂 | |
| D. | 溴化碘与氢氧化钠溶液反应时可生成两种盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com