
科目: 来源: 题型:选择题
| A. | 0.1mol/L稀硫酸中含有硫酸根数目为0.1NA | |
| B. | 通常状况下,1 NA个CO2分子占有的体积大于22.4L | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢气的体积为2.24L | |
| D. | 0.1mol NH4+中含有电子数为10NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应当坩埚中有大量固体析出时移走酒精灯用余热蒸干 | |
| C. | 先在天平两个托盘上各放一张相同质量的滤纸,再把氢氧化钠固体放在滤纸上称量 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 烧碱、液态氧、冰水混合物 | B. | 生石灰、白磷、小苏打 | ||
| C. | 干冰、铁、氨水 | D. | 空气、氮气、胆矾 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
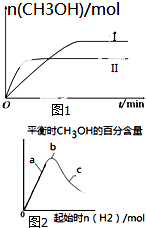 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 6 | 0.2 | 5 | 0.2 | 9 |
| C | 35 | 8 | 0.15 | 10 | 0.1 | 2 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单位时间内生成2n mol AB的同时,生成n mol的B2 | |
| B. | 平衡时容器内的总压强不随时间而变化 | |
| C. | 平衡时容器内各物质的物质的量比为1:1:2 | |
| D. | 单位时间内,生成n mol A2的同时,生成n mol的B2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某气态烃A在标准状况下的密度是1.875g/L.其核磁共振氢谱有三组峰,峰面积比为2:1:3.A有如图转化关系:
某气态烃A在标准状况下的密度是1.875g/L.其核磁共振氢谱有三组峰,峰面积比为2:1:3.A有如图转化关系:



查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com