
科目: 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、NO${\;}_{3}^{-}$ | B. | Ca2+、NO${\;}_{3}^{-}$、HCO3-、Cl- | ||
| C. | K+、OH-、Cl-、SO42- | D. | MnO${\;}_{4}^{-}$、K+、S2-、Na+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O$\frac{\underline{\;煮沸\;}}{\;}$Fe(OH)3↓+3HCl | |
| B. | 胶体分散质粒子的直径介于1~100nm之间 | |
| C. | 利用丁达尔效应可鉴别胶体和溶液 | |
| D. | 胶体和溶液都是混合物,它们属于不同的分散系 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三种气体CO、CO2、O3分别都含有1mol O,则三种气体的物质的量之比为3:2:1 | |
| B. | ng Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L X气体分子的质量为16g,则X气体的摩尔质量是32 | |
| D. | 30g CO和22.4L CO2中含有的碳原子数一定相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| KCl | K2SO4 | ZnSO4 | |
| ① | 0.3mol•L-1 | 0.2mol•L-1 | 0.1mol•L-1 |
| ② | 0.1mol•L-1 | 0.3mol•L-1 | - |
| A. | K+的物质的量相同 | B. | Cl-的物质的量相同 | ||
| C. | 完全相同 | D. | SO${\;}_{4}^{2-}$的物质的量不同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 蒸馏时温度计水银球可以高于蒸馏烧瓶支管口 | |
| C. | 振摇分液漏斗时应关闭其玻璃塞和活塞 | |
| D. | 除去KNO3中少量NaCl:将混合物制成热的饱和溶液,冷却结晶,过滤 |
查看答案和解析>>
科目: 来源: 题型:解答题
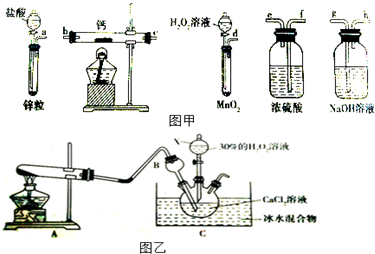
查看答案和解析>>
科目: 来源: 题型:解答题
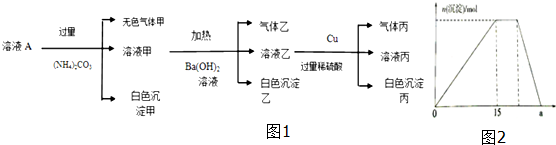
查看答案和解析>>
科目: 来源: 题型:解答题
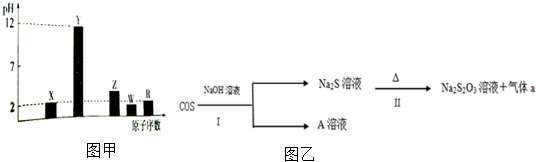
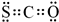 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | ①中的物质 | ②中的物质 | ③中的物质 | ③中的现象 |  |
| A | 浓氨水 | NaOH | AlCl3溶液 | 先产生白色沉淀,后沉淀溶解 | |
| B | 浓盐酸 | MnO2 | KI溶液 | 溶液变蓝色 | |
| C | 浓硫酸 | Na2SO3 | Ba(NO3)2溶液 | 无沉淀生成 | |
| D | 浓硝酸 | Cu | 含酚酞的NaOH溶液 | 溶液红色褪去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com