
科目: 来源: 题型:选择题
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4Vρ}$×100%mol/L | |
| C. | 上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 上述氨水中再加入V mL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | D、B简单离子半径大小关系为D3+>B2+ | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | 最高价氧化物对应的水化物的酸性:H2EO4>HFO4 | |
| D. | 气态氢化物的稳定性HG>HF>H2E |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| B. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| C. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 | |
| D. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 固体中阳离子和阴离子个数不一定相等 | |
| B. | 固体中一定有离子键可能有共价键 | |
| C. | 若X只含两种元素,所含元素一定不在同一周期也不在同一主族 | |
| D. | 固体中阳离子半径一定大于阴离子半径 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 L 1mol/L CH3COONa溶液中存在NA个CH3COO-离子 | |
| B. | 在标准状况下,22.4LSO3含有3NA个氧原子 | |
| C. | 1 mol Cl2参加化学反应获得的电子数都是2NA | |
| D. | 1 mol NO2气体降温后颜色变浅,其所含的原子数仍为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜片上发生了还原反应 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 正极有O2逸出 | |
| D. | 正极附近的SO42-离子浓度逐渐增大 |
查看答案和解析>>
科目: 来源: 题型:填空题
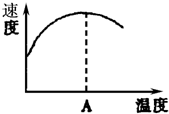 酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.查看答案和解析>>
科目: 来源: 题型:填空题
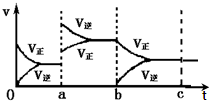 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)查看答案和解析>>
科目: 来源: 题型:解答题

 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH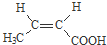 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
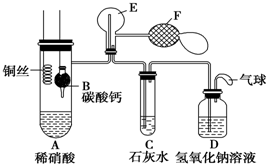 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com