
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=534.4kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534.4kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2+2H2O△H=-534.4kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目: 来源: 题型:选择题
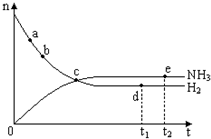 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,573K下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H=+1.9 kJ•mol-1,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3 kJ•mol-1,则含1mol NaOH的稀溶液与1mol的稀醋酸完全中和,放出的热量也等于57.3kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g))△H=a kJ•mol-1、2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,则a>b |
查看答案和解析>>
科目: 来源: 题型:解答题
 工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 沸腾炉 | B. | 吸收塔 | C. | 高炉 | D. | 接触室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com