
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1查看答案和解析>>
科目: 来源: 题型:选择题
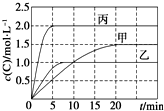 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 发生还原反应的是:H2C2O4 | |
| B. | 该离子方程式右侧横线上的产物是OH- | |
| C. | 10 mol二氧化碳生成时,电子转移5 mol | |
| D. | 通常用H2SO4溶液而不用盐酸酸化KMnO4溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2O3溶于氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+CO32- | |
| C. | NH4HCO3溶于过量的浓KOH溶液:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2S${O}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PH=0的溶液:Al3+、NH4+、Ca2+、SO42- | |
| B. | 无色溶液:Mg2+、SO42-、Fe3+、Cl- | |
| C. | 加水稀释后溶液中$\frac{(O{H}^{-})}{c({H}^{+})}$明显减小的溶液:Na+、AlO2-、S2-、SO32- | |
| D. | 加入铝粉产生H2的溶液中,Fe2+、K+、NO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 1 mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA | |
| D. | 1 L 0.1 mol•L-1 NaHCO3溶液中含有0.1 NA个HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 雪白、漂亮的“白木耳”,可能是在用硫黄熏制的过程中产生的SO2所致 | |
| B. | 钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| D. | 硅胶可用作食品干燥剂和催化剂载体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com