
科目: 来源: 题型:解答题
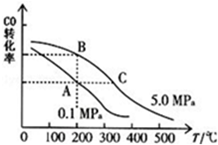
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | H2(g)+12O2(g)═H2O(g)△H=-285.8kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| 总压强p/100kPa | 4.00 | 4.20 | 4.50 | 5.20 | 6.00 | 6.00 |
查看答案和解析>>
科目: 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
| 物质 | C(s) | H2(g) | C2H4(g) | C2H6(g) | C3H8(g) | C12H26(l) |
| △H/ kJ•mol-1 | -393.5 | -285.8 | -1 411.0 | -1 559.8 | -2 219.9 | -8 571.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com