
科目: 来源: 题型:解答题
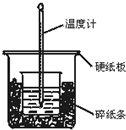 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验 次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目: 来源: 题型:填空题
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |

查看答案和解析>>
科目: 来源: 题型:填空题
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| c/mol•L-1 | 0 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
查看答案和解析>>
科目: 来源: 题型:填空题
 (1)化学键的键能是指气态原子间形成1mol化学键时释放的能量.下表列出了某些化学键的键能:
(1)化学键的键能是指气态原子间形成1mol化学键时释放的能量.下表列出了某些化学键的键能:| 化学键 | H-H | O═O | O-H |
| 键能 (kJ•mol-1) | 436 | x | 463 |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.
已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.| A. | -124 | B. | +124 | C. | -288 | D. | +288 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO量不变 | C. | 氧气浓度不变 | D. | 平衡向右移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| B. | 实验室可用排饱和食盐水的方法收集氯气 | |
| C. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| D. | 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com