
科目: 来源: 题型:解答题

 ,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.
,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 | |
| B. | 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中 | |
| C. | 实验室可以用湿润的淀粉KI试纸鉴别二氧化氮和溴蒸气 | |
| D. | 从碘的CCl4溶液获得单质碘的实验方法是蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑤ | C. | ①③ | D. | ①④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-=NH3•H2O+BaCO3↓+H2O | |
| B. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 苏打溶液与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 向澄清石灰水中通入过量CO2:OH-+CO2=HCO3- |
查看答案和解析>>
科目: 来源: 题型:填空题
 随着人类对环境和资源短缺等问题的重视,如何降低大气中有害气体的含量及对其有效地开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO来生产燃料甲醇.一定条件下的密闭容器中,CO和H2生成甲醇的反应:CO(g)+2H2(g)?CH3OH(g);
随着人类对环境和资源短缺等问题的重视,如何降低大气中有害气体的含量及对其有效地开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO来生产燃料甲醇.一定条件下的密闭容器中,CO和H2生成甲醇的反应:CO(g)+2H2(g)?CH3OH(g);查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
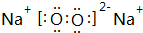 ;
; ,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大 | |
| B. | 0.2 mol•L-lNH4CI 和 0.l mol•L-lNaOH 溶液等体积混合后:c(NH4+)>c (Cl-)>c (Na+)>c (OH-)>c (H+) | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c (Na+)+c(H+)=c (S2-)+c (HS-)+c (OH-) | |
| D. | 同浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl ③CH3COONH4④NH3•H2O; c(NH4+) 由大到小的顺序是:①>②>③>④ |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | 稀释后X溶液中水的电离程度比Y溶液中水电离程度小 | |
| B. | 若X、Y是一元碱,等物质的量浓度的盐酸盐溶液Y的pH大 | |
| C. | 若8<a<10,则X、Y都是弱碱 | |
| D. | 完全中和X,Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、Y的转化率不相等 | |
| B. | 平衡时,Y和Z的生成速率之比为3:2 | |
| C. | c1:c2=1:3 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com