
科目: 来源: 题型:解答题
 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
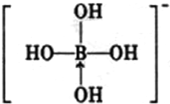 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
 X、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能
X、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 离子键 | B. | 配位键 | C. | 金属键 | D. | 氢键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配合物[Zn(NH3)4]Cl2配位数为6 | |
| B. | 配合物[Zn(NH3)4]Cl2中,配体为NH3和Cl-,[Zn(NH3)4]2+为内界 | |
| C. | 配合物[Zn(NH3)4]Cl2中Zn2+和NH3以离子键结合 | |
| D. | 在NH4+和Fe(CO)5中都存在配位键 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶质的质量分数 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | w1 | ρ1 |
| 氨水 | c2 | w2 | ρ2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
| H2O(l) | 170g | 9.20g | 1.50×10-4g | 33.3g |
| NH3(l) | 86.0g | 97.2g | 0.80g | 0.00g |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.0 mo1 | B. | 1.5 mo1 | C. | 1.0 mo1 | D. | 0.75 mo1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com