
科目: 来源: 题型:填空题
 下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、Cl-中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1mol•L-1硝酸,实验过程中沉淀质量的变化如图所示:
下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、Cl-中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1mol•L-1硝酸,实验过程中沉淀质量的变化如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
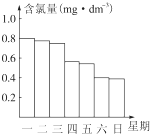 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 往溶液中通入氯气:Ca2+、CH3COO-、Br-、Na+ | |
| B. | 碱性溶液:Na+、SO42-、Cl-、ClO- | |
| C. | 加入浓盐酸的溶液:Fe2+、K+、NO${\;}_{3}^{-}$、NH4+ | |
| D. | 加入KSCN呈血红色的溶液:K+、Ca2+、Br-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com