
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀 | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀 | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 反应叙述 | 产物图示 |
| A | NaOH溶液与SO2 反应时溶液中的溶质 |  |
| B | NaAlO2溶液与盐酸反 应后铝元素的存在形式 |  |
| C | Fe和稀HNO3反应 后,铁元素的存在形式 | 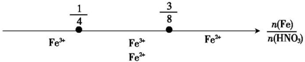 |
| D | Fe在Cl2中的燃烧产物 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )| A. | 根据隔板K滑动与否可判断左右两边的反应是否达到平衡 | |
| B. | 达到平衡后,隔板K最终停留在左侧刻度0--2之间 | |
| C. | 到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 | |
| D. | 若平衡时K停留在左侧1处,则活塞停留在右侧5--6之间 |
查看答案和解析>>
科目: 来源: 题型:填空题
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如表所示.
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如表所示.| 溶质的物质的量浓度/mol•L-1 | 溶质的质量分数 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | w1 | ρ1 |
| 氨水 | c2 | w2 | ρ2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com