
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
查看答案和解析>>
科目: 来源: 题型:解答题
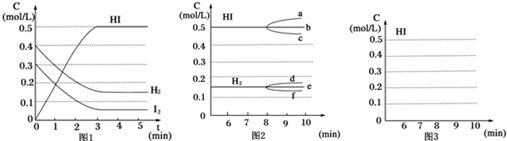
查看答案和解析>>
科目: 来源: 题型:选择题
 如图中电流表的指针发生偏移,且B棒的质量增加,则可能的情况是( )
如图中电流表的指针发生偏移,且B棒的质量增加,则可能的情况是( )| A. | ①③ | B. | ①④ | C. | ② | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:多选题
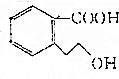 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | M的分子式为C9H10O3 | |
| B. | M 可使酸性KMnO4溶液褪色 | |
| C. | 1 mol M完全燃烧消耗10 mol O2 | |
| D. | 1 mol M能与足量Na反应生成0.5 mol H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下在水中溶解性比KHCO3>K2CO3 | |
| B. | 热稳定性K2CO3<KHCO3 | |
| C. | 和酸反应放出CO2的快慢KHCO3>K2CO3 | |
| D. | 等量的盐酸分别与足量KHCO3和K2CO3反应,产生CO2一样多 |
查看答案和解析>>
科目: 来源: 题型:解答题
 双氧水是一种常见的氧化剂,也可作还原剂.实验室用H2O2制取氧气的原理和装置如下:2KMnO4+3H2SO4+5H2O2═K2SO4+2MnSO4+8H2O+5O2↑
双氧水是一种常见的氧化剂,也可作还原剂.实验室用H2O2制取氧气的原理和装置如下:2KMnO4+3H2SO4+5H2O2═K2SO4+2MnSO4+8H2O+5O2↑查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 较浓稀硫酸 | C. | 碳酸钠溶液 | D. | 硝酸银溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 强酸性溶液中:ClO-、S2-、SO32-、Na+ | |
| B. | 强碱性溶液中:ClO-、S2-、SO32-、Na+ | |
| C. | 使甲基橙变黄的溶液中:Fe3+,MnO4-,NO3-,Na+,SO42- | |
| D. | c(HCO3-)=0.1mol•L-1的溶液中:Na+、K+、CO32-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com