
科目: 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | O.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.查看答案和解析>>
科目: 来源: 题型:解答题
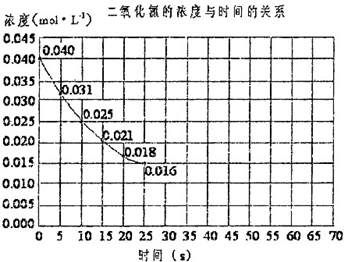
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 凡是化合反应都是放热反应,分解反应都是吸热反应 | |
| B. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| C. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| D. | 书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态 |
查看答案和解析>>
科目: 来源: 题型:解答题
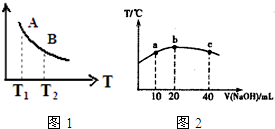 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 发生的反应都是置换反应 | B. | 实验所得滤液是纯水,可直接排放 | ||
| C. | 滤渣中一定含铜和锌 | D. | 反应前后液体的酸性减弱,pH变小 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
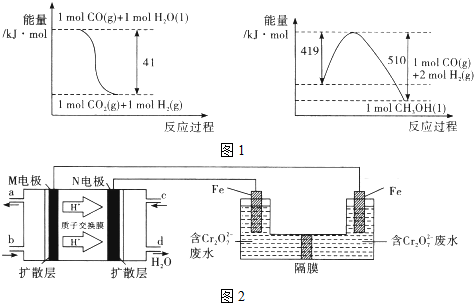
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com