
科目: 来源: 题型:选择题
| A. | 18g水所含分子数目为NA,体积约为24.5L | |
| B. | 0.1mol•L-1的NaNO3溶液中含有0.1NA个NO3- | |
| C. | 1mol Fe与足量的盐酸反应,转移3NA个电子 | |
| D. | 2.3g钠离子所含电子数目为1NA |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目: 来源: 题型:解答题
 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+.查看答案和解析>>
科目: 来源: 题型:解答题
 工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.按照相同的物质的量投料,测得SO2在不同温度下的平衡转
工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.按照相同的物质的量投料,测得SO2在不同温度下的平衡转查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 向氢氧化钠溶液中通入二氧化碳:2OH-+CO2=CO32-+H2O | |
| C. | 澄清石灰水与稀盐酸反应:Ca (OH)2+2H+=Ca2++2H2O | |
| D. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  用图所示装置验证NaHCO3的不稳定性 用图所示装置验证NaHCO3的不稳定性 | |
| B. | 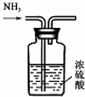 用图所示装置干燥氨气 用图所示装置干燥氨气 | |
| C. | 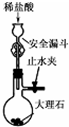 用图所示装置制取少量CO2气体 用图所示装置制取少量CO2气体 | |
| D. |  用图所示装置分馏石油 用图所示装置分馏石油 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com