
科目: 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 0.5mol•L-1盐酸 | C. | 0.5mol•L-1H2SO4 | D. | 自来水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食物溶于水后的溶液pH<7,则为酸性食物 | |
| B. | 由C、H、O、N、S、P等元素组成的蛋白质是酸性食物 | |
| C. | 蔬菜、水果多含钾、钠、钙、镁等盐类及果酸,习惯称为酸性食物 | |
| D. | 柠檬是酸性食物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡膳食就是各食物都要吃 | |
| B. | 摄入食物中的营养素种类齐全,数量充足,比例适当且与人体的需要的保持平衡才是合理的膳食结构 | |
| C. | 淀粉、油脂、蛋白质为人体提供热能,所以只要这三种摄入量足够就可 | |
| D. | 为维持人体内电解质平衡,人在大量出汗后应及时补充Ca2+离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HCl+Na2CO3 HCl+NaHCO3 | B. | HCl+Na2CO3 H2SO4+K2CO3 | ||
| C. | H2S+NaOH H2SO4+KOH | D. | BaCl2+Na2SO4 BaCO3+H2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目: 来源: 题型:解答题
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 全部 | B. | ③⑤⑥ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | a是电源的正极 | |
| B. | 电子流动的方向:d→b | |
| C. | c极发生氧化反应 | |
| D. | 如果将c、d两电极互换,则c上也会生成黄绿色气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 445.15 kJ•mol-1 | B. | 607.3 kJ•mol-1 | C. | 890.3 kJ•mol-1 | D. | 802.3 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
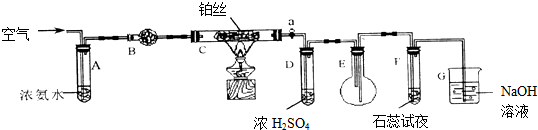
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com