
科目: 来源: 题型:解答题
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察下图,然后回答问题.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增加Fe的量,正反应速率增大 | |
| B. | 将容器的体积缩小一半,正逆反应速率增大 | |
| C. | 保持体积不变,充入Ne,正逆反应速率增大 | |
| D. | 保持压强不变,充入Ne,正逆反应速率不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
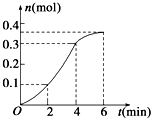
| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H1>△H3>△H2 | C. | △H3>△H2>△H1 | D. | △H2>△H1>△H3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO42-、NO3- | B. | NO3-、Cl- | C. | SO32-、NO3- | D. | Cl-、NO3-、Na+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 电解过程中溶液pH不会变化 | |
| C. | 过程中有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
查看答案和解析>>
科目: 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.3 mol/(L•min) | |
| B. | 12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的$\frac{1}{5}$ | |
| C. | 若增大X的浓度,则物质Y的转化率减小 | |
| D. | 经12 s达到平衡后,2v(X)=v(Z) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 没有物质的变化,就没有能量的变化 | |
| C. | 热化学方程式中,化学式前面的化学计量数只表示物质的量,不表示微粒数 | |
| D. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com