
科目: 来源: 题型:选择题
| A. | 0.005 mol | B. | 0.03 mol | C. | 0.02 mol | D. | 0.01 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O的摩尔质量为18g | |
| B. | 1mol O2的质量为32g•mol-1 | |
| C. | 相同质量的O2和O3,所含分子数不同,所含原子数相同 | |
| D. | 相同物质的量的CO2 和CO,所含O原子的个数比为1:1 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| B. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | 某溶液中加入CCl4,CC14层显紫色,证明原溶液中存在I- | |
| D. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
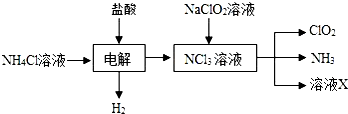

查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该反应属于取代反应,CPAE含有三类官能团 | |
| B. | CPAE的分子式为C17H16O4 | |
| C. | 苯乙醇属于醇类,含有苯环的醇类同分异构体有四种 | |
| D. |  与咖啡酸互为同分异构体 与咖啡酸互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4g 氦气 | B. | 1.25mol O2 | ||
| C. | 22.4升 Cl2(标准状况) | D. | 6.02×1023个SO2分子 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| A | Z存在质量数为23,中字数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com