
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①=③>②>④ | B. | ①>②>④>③ | C. | ③>①=②>④ | D. | ④>③>②>① |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{1}{6}$ | B. | $\frac{1}{4}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只要在室内放一盆水 | |
| B. | 向地势低的地方撤离 | |
| C. | 观察风向,顺风撤离 | |
| D. | 用湿毛巾或蘸有弱碱性溶液的毛巾捂住口鼻撤离 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
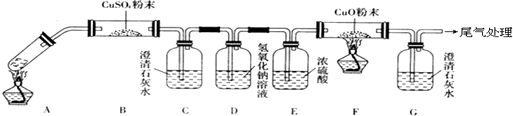
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | HA的物质的量浓度(mol/L) | NaOH的物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com