
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示:
以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
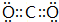 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 将1molFeCl3水解制成胶体,所得胶体的胶粒数为NA | |
| C. | 0.5mol NH4HSO4晶体中,含有H+数目为0.5NA | |
| D. | 18gD2O含有的电子数为10NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若容器中混合气体的平均相对分子质量不变,则该反应达到平衡状态 | |
| B. | 升高温度,平衡向逆反应方向移动 | |
| C. | 加入H2和使用催化剂均可提高CO的转化率 | |
| D. | 平衡时,分离出CH3OH,逆反应速率先减小,后逐渐增大,平衡正向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| B. | 白磷比红磷稳定 | |
| C. | 石墨转变为金刚石是吸热反应 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2(g)△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com