
科目: 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ/mol) | 414 | 489 | 565 | 155 |
| A. | -485kj/mol | B. | +485kj/mol | C. | +l940kj/mol | D. | -l940kj/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c<d | B. | 0.5a>b | ||
| C. | 氢气的燃烧热为akj/mol | D. | 一氧化碳的燃烧热为(d-c)kj/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
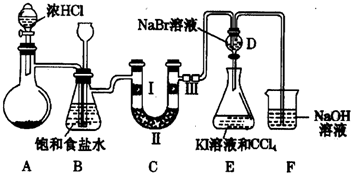
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酯、A、B三种物质的分子中都含一种相同的式量大于45的原子团 | |
| B. | A的式量比B大14 | |
| C. | B的式量比A大16 | |
| D. | 该酯中一定不含双键等不饱和键 |
查看答案和解析>>
科目: 来源: 题型:选择题
 的说法中正确的是( )
的说法中正确的是( )| A. | 在浓硫酸作用下可水解成相应的醇 | |
| B. | 滴加AgNO3溶液可产生白色沉淀 | |
| C. | 该卤代烃发生消去反应只能生成一种烯烃 | |
| D. | 该卤代烃经过消去、加成、消去只能生成一种烯烃 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时,正极发生的反应是:Pb(s)+SO${\;}_{4}^{2-}$(aq)-2e-═PbSO4(s) | |
| B. | 充电时,每消耗1molPbSO4的同时转移2mol电子 | |
| C. | 放电时,该电池的负极材料是铅板 | |
| D. | 充电时,电池中硫酸的浓度不断变小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 改用浓度为0.5 mol•L-1的稀硫酸 | B. | 加入更多的碳酸钙 | ||
| C. | 稍微加热,升高反应温度 | D. | 改用浓度为2 mol•L-1的稀盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | b+Q-a kJ/mol | B. | 2b-Q-a kJ/mol | C. | 2b+Q-a kJ/mol | D. | b-Q+a kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com