
科目: 来源: 题型:选择题
| A. | 0.5mol/L的Ba(0H)2溶液中0H一的数目为NA | |
| B. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1.6gNH2-离子所含质子数为NA | |
| D. | 92g NO2和N204混合气体中含有的原子数为6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2s末用物质A表示的反应速率为0.3mol/(L•s) | |
| B. | 2s内用物质B表示的反应速率为0.15mol/(L•s) | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的浓度为1.4 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 | |
| B. | 化学反应必定同时遵循质量守恒和能量守恒 | |
| C. | 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 | |
| D. | 已知:C(石墨,s)═C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L | |
| B. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 | |
| C. | 平衡时,乙中CO2的转化率大于60% | |
| D. | 平衡时,甲中和丙中H2的转化率均是60% |
查看答案和解析>>
科目: 来源: 题型:选择题
 生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是( )
生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是( )| A. | 正极的电极反应式可能是O2+4e-═2O2- | |
| B. | 负极的电极反应式可能是O2+4e-+2H2O═4OH- | |
| C. | 正极反应主要是C6H12O6生成CO2或HCO3- | |
| D. | 负极反应主要是C6H12O6生成CO2或HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |

查看答案和解析>>
科目: 来源: 题型:解答题
| t(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
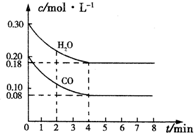 (1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,
(1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,| t/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com