
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L 14CO2与44 g 14CO2含分子数均为NA | |
| B. | 1 mol CH3COOH与足量CH3CH2OH在浓硫酸存在下共热生成NA个乙酸乙酯分子 | |
| C. | 常温下,pH=13的NaOH溶液中含OH-离子数为0.1 NA | |
| D. | 浓度为2 mol/L的FeCl3溶液500 mL水解后生成Fe(OH)3胶体粒子数目小于NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 鉴别乙烷与乙烯或除去乙烷中的少量乙烯杂质都可用高锰酸钾酸性溶液 | |
| B. | 某同学需用480 mL 2.0 moI•L-1氢氧化钠溶液进行实验,则配制该溶液时他称取氢氧化钠固体质量一定是38.4 g | |
| C. | 向含Fe3+的溶液中加入KSCN溶液时一定有红褐色沉淀产生 | |
| D. | 硝酸钾和稀硫酸的混合溶液中加入铜粉后,溶液会慢慢变蓝 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mL NO | B. | 2 mL NO2和0.5 mL O2 | ||
| C. | 2 mL O2 | D. | 0.25 mL O2 |
查看答案和解析>>
科目: 来源: 题型:解答题
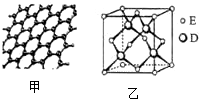 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 离子组 | 条件 |
| A | K+、Na+、Cu2+、Cl- | 溶液呈无色 |
| B | Na+、Fe3+、NO3-、SO42- | 滴入酸性KMnO4溶液,溶液褪色 |
| C | Al3+、SO42-、Cl-、H+ | 加入氨水产生白色沉淀后沉淀溶解 |
| D | Na+、NO3-、I-、SO42- | 加入盐酸和淀粉溶液变蓝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: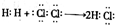 | |
| B. | Mg2+的结构示意图: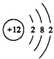 | |
| C. | HClO的结构式:H-Cl-O | |
| D. | 质量数为133,中子数为78的铯原子:${\;}_{55}^{133}$Cs |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 大量化石燃料的燃烧是造成雾霾天气的一种重要因素 | |
| B. | 含重金属离子的电镀液不能随意排放 | |
| C. | 煤经过汽化和液化两个物理变化过程后变为清洁能源,这是煤的综合利用的方法 | |
| D. | 改进汽车尾气净化技术,减少大气污染物的排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com