
科目: 来源: 题型:解答题
 A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.
A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子. .
.查看答案和解析>>
科目: 来源: 题型:解答题

| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
查看答案和解析>>
科目: 来源: 题型:解答题

| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的Ph | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
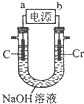
查看答案和解析>>
科目: 来源: 题型:选择题

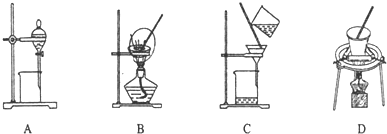
| A. | 容量瓶、分液漏斗和滴定管都需要验漏 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙加热分解NaHCO3固体 | |
| D. | 配制500mL0.1mol•L?1NaCl溶液用到的玻璃仪器只有500mL容量瓶、烧杯和玻璃棒 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2C1O-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ | |
| C. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+═2Fe3++2H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
 四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C二种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物.回答下列问题:
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C二种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 .P元素属于p区元素,
.P元素属于p区元素,
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶解 加适量BaCl2溶液 过滤 | |
| B. | 溶解 加适量CaCl2溶液 过滤 | |
| C. | 溶解 加适量Ca(OH)2溶液 过滤 | |
| D. | 溶解 加适量盐酸 加热 |
查看答案和解析>>
科目: 来源: 题型:解答题
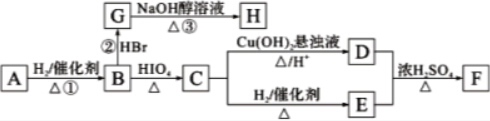
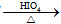 RCHO+R′CHO
RCHO+R′CHO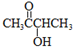 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下①溶液显碱性,其主要原因为:CO32-+H2O=HCO3-+OH- | |
| B. | 可用澄清石灰水来鉴别①和②两种无色溶液 | |
| C. | 泡沫灭火器中用硫酸铝溶液和②混合快速产生CO2的反应原理为:Al3++3HCO3-=Al(OH)3↓+3CO2↑ | |
| D. | 无论①和②以何种比例、何种浓度混合,都一定有:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com