
科目: 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物时,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 反应:Na2O2(s)+2 Na(s)=2Na2O(s)△H=-317kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示). ,
,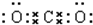 .
. 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目: 来源: 题型:解答题
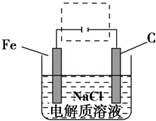 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑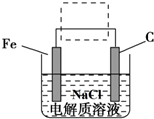
查看答案和解析>>
科目: 来源: 题型:解答题


 Al3++3HCO3-=Al(OH)3↓+3CO2↑.
Al3++3HCO3-=Al(OH)3↓+3CO2↑. Al(OH)3+3H+═Al3++3H2O.
Al(OH)3+3H+═Al3++3H2O.查看答案和解析>>
科目: 来源: 题型:解答题
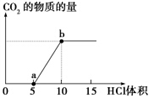 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛应用.
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛应用.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中一定存在Fe2+ | B. | 溶液中一定存在Fe3+ | ||
| C. | 溶液中一定存在Cu2+ | D. | 溶液中一定不存在Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | N2 | Cl2 | Br2 | I2 | O2 |
| 键能 (kJ•mol-1) | 945 | 243 | 193 | 151 | 498 |
| 键长(nm) | 0.110 | 0.199 | 0.228 | 0.266 | 0.121 |
| A. | N2>Cl2>Br2>O2>I2 | B. | O2>N2>I2>Br2>Cl2 | ||
| C. | I2>Br2>Cl2>O2>N2 | D. | N2>O2>Cl2>Br2>I2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中 | |
| B. | SiO2可与水反应生成H2SiO3 | |
| C. | 向氯水中加CaCO3粉末,可提高溶液中HClO的浓度 | |
| D. | 向氯水中滴加蓝色石蕊试液先变红后褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2是淡黄色固体,Na2O 是白色固体,二者都能与水反应生成 NaOH | |
| B. | Na和O2在加热时反应生成 Na2O2,在常温下反应生成 Na2O | |
| C. | Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成 O2 | |
| D. | 2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com